 Vers
la page d'accueil
d'OPIE-Insectes
Vers
la page d'accueil
d'OPIE-Insectes
Vers le sommaire de l'ouvrage. Vers la page Lymantria dispar.
 Vers
la page d'accueil
d'OPIE-Insectes
Vers
la page d'accueil
d'OPIE-Insectes
Vers le sommaire de l'ouvrage. Vers la page
Lymantria dispar.
ENNEMIS DES CHENILLES ET DES CHRYSALIDES
C. VILLEMANT
Principales espèces : Cotesia (Apanteles)
melanoscela, Glyptapanteles
(Apanteles) porthetriae et Dolichogenidea
(Apanteles) lacteicolor, Meteorus
pulchricornis, Palexorista
(Sturmia) inconspicua, Brachymeria
intermedia, Calosoma sycophanta.
1. Diversité spécifique et impact
Chacune des écophases successives du Bombyx disparate possède son cortège d'ennemis naturels qui, à l'exception des antagonistes des pontes (cf. ann. A1), est peu diversifié par rapport à ce qu'on connaît du reste de l'aire de répartition du ravageur (HERARD et FRAVAL, 1980).
Nous dressons, dans le tableau IX, l'inventaire à jour des ennemis des chenilles et des chrysalides de Lymantria dispar (L.) (Lép. Lymantriidae) en subéraie atlantique marocaine. Les 1ers stades larvaires sont attaqués par les Braconides solitaires "Apanteles" spp. et Meteorus pulchricornis (WESMAEL). Les chenilles âgées sont parasitées par plusieurs espèces de Tachinaires, et les chrysalides par le Chalcidien Brachymeria intermedia (NEES), et plus rarement par des Ichneumonidae. Les prédateurs sont encore moins abondants que les parasitoïdes, ce sont surtout des oiseaux, des Coléoptères et des Fourmis. Tous les antagonistes sont des ennemis "naturels", aucune introduction n'ayant été tentée hormis celle du Baculovirus (FRAVAL et al., 1981).
Ce texte ne présente que les antagonistes les plus importants, une présentation plus complète ayant été donnée par ailleurs (VILLEMANT, 1989).
Tableau IX: Ennemis des chenilles et des chrysalides de Lymantria
disparen subéraie marocaine atlantique.
* d'après l'U.S.D.A. (Projet F12-ENT1)
** VILLEMANT, 1985, non publ.
*** VILLEMANT et KASSIM, 1988, non publ.



Le complexe des ennemis des chenilles et des chrysalides est proche, dans sa composition spécifique, de celui des autres pays d'Afrique du Nord (RABASSE et BABAULT, 1975; HAMRA-KROUA, 1986). Mais il diffère de celui connu dans les pays européens voisins par le petit nombre des espèces et leur impact global généralement faible (HERARD et FRAVAL, 1980). Cette faible diversité spécifique est liée au caractère récent de l'introduction de L. dispar au Maroc (GOLDSCHMIDT, 1934; FRAVAL, 1986b). Parmi les insectes parasitoïdes absents citons le Braconide grégaire Glyptapanteles liparidis (BOUCHE) signalé en Espagne et en France et les Tachinaires oligophages Blepharipa pratensis (MEIGEN) (= scutellata R.D.) et Parasetigena silvestris (= agilis Auct.) présentes dans ces deux pays comme en Italie (ROMANYK, 1973; DREA, 1978; LUCIANO et PROTA, 1982). Dans beaucoup de pays méditerranéens,les pullulations sont aussi fréquemment jugulées par des épozooties diverses dues à des protozoaires, des bactéries ou des virus (ROMANYK, 1966; CABRAL, 1977; LUCIANO et PROTA, 1985; FUESTER et al., 1983; VASILSEVIC et INJAC, 1984), notamment le Baculovirus de L. dispar, agent de la polyédrose nucléaire (NPV) dont l'introduction en 1978 au Maroc par FRAVAL et al. (1981a) n'a pas été suivie semble-t-il d'acclimatation (FRAVAL, 1986b). Les seules maladies signalées en Maroc, une "grasserie" (DE LEPINEY, 1930), une "virose" et des attaques du champignon Beauveria sp. sur les chrysalides (DI-PIETRO, 1979b) sont toujours demeurées très localisées, n'affectant qu'un petit nombre d'individus (FRAVAL, loc. cit.).
Les entomophages sont souvent considérés comme des agents de régulation importants des populations de ravageurs forestiers, mais le très fort potentiel biotique de L. dispar en progradation dépasse généralement les capacités de destruction de ses ennemis naturels au Maroc (FRAVAL, 1986b). Parasites et prédateurs ne se montrent réellement agressifs qu'envers les populations du ravageur à régime latent permanent ou durant les phases de rétrogradation et de latence des populations à régime cyclique; ils sont incapables de limiter à eux seuls le développement d'une gradation (CHAKIR et FRAVAL, 1985; FRAVAL, 1986b) (cf. chap. V). La même constatation a été faite dans de nombreux pays (SEMEVSKY, n.d.; ROMANYK, 1973; WESELOH, 1973a; SISOSEVIC, 1975; CAMPBELL et SLOAN, 1977, LUCIANO et PROTA, 1984). La composition du complexe parasitaire de L. dispar en un lieu donné varie au cours du temps et les espèces dominantes ne sont pas toujours les mêmes selon la phase de la gradation (BARBOSA et al., 1975; REARDON, 1976; SISOSEVIC, 1979; FUESTER et al., 1983).
D'après les relevés effectués dans le nord du canton B de la Mamora lors de la dernière gradation du défoliateur, les plus forts taux de parasitisme des chenilles ont été enregistrés au printemps 1981, en pleine période de rétrogradation du ravageur; la mortalité totale ne dépassait pas 30 % des effectifs de chenilles, pourtant peu denses (CHAKIR et FRAVAL, 1985). Ces chiffres sont proches de ceux de DE LEPINEY (1930). Le parasitisme dû aux Tachinides n'a guère depassé 1 à 2% en Mamora sauf en 1981 où il atteignait exceptionnellement 18% (CHAKIR, 1981).
La presque totalité du parasitisme nymphal est due au Chalcidien B. intermedia. En 1925, le long de la route Salé-Meknès, il a détruit plus de 90% des chrysalides de L. dispar (DE LEPINEY, 1930). Jusqu'en 1985 son impact est toujours resté faible en Mamora, atteignant 5 % en 1976 et 14% en 1981 (CHAKIR et FRAVAL, 1985).
Quant aux prédateurs, ils sont toujours demeurés extrèmement discrets. L'activité prédatrice des oiseaux sur les chenilles est difficile à évaluer d'autant plus qu'elle n'a jamais été très manifeste (DE LEPINEY, 1930). Le Calosome (en Mamora) n'a eu de réelle efficacité qu'en 1979 sur les chrysalides d'une population localisée et peu dense du ravageur (FRAVAL et al., 1981a; FRAVAL, 1986b).
A partir de 1987 on a constaté des taux de parasitisme tout à fait exceptionnels dans une population de L. dispar présentant une pullulation très localisée aux environs de Kénitra (RAMZI, 1987; KASSIM, 1988; FRAVAL et al., 1989. En 1987 et 1988, entre avril et mai, les parasites larvaires (pour les 2/3, les Braconides C. melanoscela et M. pulchricornis) ont détruit plus de 70% des chenilles, prévenant ainsi en grande partie les défoliations. A leur action s'est ajoutée celle des parasites des chrysalides, elle aussi exceptionnellement forte, B. intermedia tuant à chaque fois plus de 50 % des chrysalides.
Les parasites de L. dispar dans les autres subéraies du Maroc ont été très peu étudiés. Les Tachinaires, actives en 1973 dans les régions de moyenne montagne, ont provoqué des mortalités maximales à Chaouen (23 %) et dans le Tazzeka (66 %). A Bou-Hani, en 1985, nous avons observé un fort impact des Tachinaires sur les populations du ravageur en 2ème année de culmination, par ailleurs fortement parasitées par B. intermedia (VILLEMANT, 1985, non publié).2.
2. Les parasites des jeunes chenilles et leurs ennemis
Quatre espèces de parasitoïdes s'attaquent aux 3 premiers stades larvaires de L. dispar. Ce sont tous des endoparasites solitaires et polyvoltins qui ont besoin d'un hôte intermédiaire pour achever leur cycle annuel. Les femelles déposent leur oeufs isolement à l'intérieur du corps des jeunes chenilles. Les larves âgées quittent leur hôte et tissent leur cocon de nymphose à proximité de leur victime. Caractéristiques par leur forme et leur couleur, ces cocons permettent une reconnaissance rapide des différentes espèces, ainsi que l'évaluation de l'impact, généralement fort, des hyperparasites.
2.1. Cotesia (Apanteles) melanoscela (fig. 29a et b)
L'espèce a longtemps été nommée Apanteles solitarius (RATZ.). Son cocon est blanc jaunâtre. Il fixe la plupart du temps la chenille mourante au support (feuille ou écorce). L'adulte, petit (2-3 mm), est de couleur noire; ses pattes sont plus ou moins tachées de jaune à leur extrémité.
Répandu en Afrique du Nord comme dans la plupart des pays européens et en Asie, Cotesia (Apanteles) melanoscela (RATZEBURG) a été envoyé en grand nombre en Amérique du Nord où il s'est largement répandu (WESELOH et ANDERSON, 1975; GRIFFITHS, 1976; SIMONS et al.), 1979; QUEDNAU, 1983; COULSON et al., 1986). Son efficacité est très variable, les mortalités qu'il provoque, souvent en association avec d'autres espèces, dépassent rarement 20 % en Europe (ROMANYK, 1966; DREA, 1978; LUCIANO et al., 1982; FUESTER et al., 1983) mais peuvent atteindre localement des proportions très élevées (SHAPIRO, 1956). Au Maroc, DE LEPINEY (1927) estimait son impact à 20 - 25 % en moyenne. Le parasitoïde, très peu actif au cours de la gradation de L. dispar entre 1972 et 1981 (CHAKIR et FRAVAL, 1985) a détruit environ la moitié des jeunes chenilles du défoliateur en 1987 et 1988 (KASSIM, 1988; FRAVAL et al., 1989).
La biologie de C. melanoscela, revue au Maroc par DE LEPINEY, 1927; 1930) a fait l'objet de nombreuses études récentes par les chercheurs américains (REARDON et al., 1973; WESELOH, 1973b; 1980; CAMPBELL, 1975; DOANE èet McMANUS, 1981). C'est l'un des parasites de L. dispar les mieux connus.
C. melanoscela peut présenter 2 et même 3 générations printanières, les 2 premières s'effectuant sur L. dispar si les éclosions du ravageur s'échelonnent sur plus de 2 mois. Cette particularité signalée par DE LEPINEY (1930) a été confirmée depuis (FUESTER et al., 1983; KASSIM, 1988). Elle a certainement favorisé en grande partie les forts taux de parasitisme observés en 1987 et 1988. Les adultes de la 3ème génération (mais aussi ceux de la seconde, si les éclosions de l'hôte sont plus groupées) doivent trouver un hôte intermédiaire qui est souvent le Lymantriide Orgya trigotephras (BOISDUVAL) (BASTAOUI, 1983; DAHHOU, 1984) mais probablement aussi les chenilles d'autres Lépidoptères dont le développement est plus tardif (cf. Ann. C)
L'abondance des hôtes intermédiaires, tout comme la bonne coïncidence phénologique du parasite avec ses hôtes, conditionne en grande partie ses possibilités de survie et de multiplication et par là, son impact sur L. dispar (WESELOH, 1976; RAFFA, 1977; DOANE et McMANUS, 1981).
Les adultes de la génération hivernante émergent au moment des premières éclosions de L. dispar. Les femelles fécondées 2 à 3 h après l'émergence peuvent déposer plus de 500 oeufs à raison d'environ 15 attaques par jour. La reconnaissance de l'hôte est favorisée par une kairomone, substance volatile produite par les chenilles et très attractive pour le parasite (LEONARD et al., 1975; WESELOH, 1980; 1987a). La seule piqûre du parasitoïde peut être fatale aux chenilles nouveau-nées. Les cas de superparasitisme sont fréquents mais l'une des larves élimine rapidement ses congénères (DOANE et McMANUS, 1981).
L'oeuf éclot au bout de 2 à 4 jours et les 3 stades larvaires durent chacun environ 1 semaine; l'adulte émerge 5 à 9 jours après le tissage du cocon de nymphose en détachant un petit opercule à son extrémité antérieure.Les femelles de la 2ème génération ne s'attaquent à L. dispar que si les chenilles sont suffisamment petites; bien que leurs oeufs puissent s'y développer, les femelles de C. melanoscela évitent les chenilles du 4ème stade à cause de leur forte pilosité et des mécanismes de défense (contorsions) qu'elles manifestent (WESELOH, 1976; 1986c; WESELOH et ANDEREADIS, 1982).
Certaines larves âgées de la seconde génération entrent en diapause et se maintiendront dans leur cocon, en estivo-hivernation jusqu'au printemps de l'année suivante. La 3ème génération, issue des individus non diapausantsdonnera à son tour des larves estivo-hivernantes dont les cocons sont souvent plus grands que ceux des larves non diapausantes. D'autres individus de cette dernière génération pourraient passer l'hiver à l'état de jeune larve dans les chenilles d'un hôte intermédiaire (Lépidoptère ou Tenthrède) (SHAPIRO, 1956; REARDON et al., 1973; WESELOH, 1973b). Selon ce dernier auteur, les courtes photopériodes (moins de 16 h) entrainent l'entrée en diapause de la totalité des individus; à plus de 18 h/j de lumière au contraire, très peu de larves sont concernées.Ceci explique peut-être en partie le très faible nombre de cocons en estivo-hivernation que l'on peut récolter en Mamora.
Les cocons de C. melanoscela subissent, en outre, une très forte attaque des hyperparasites et de certains prédateurs (Fourmis), anéantissant parfois toute chance de survie aux individus diapausants (DE LEPINEY, 1930; SCHEDL, 1936; WESELOH, 1983; QUEDNAU, 1983). Cependant, les hyperparasites n'exploitent pas toujours bien les populations denses de C. melanoscela (WESELOH, 1986d).
En juin 1988 la mortalité du parasitoïde en Mamora a été analysée sur le terrain: 16% des cocons trouvés sur les troncs étaient parasités et 6 % seulement non éclos (morts ou diapausants). Des chiffres très proches ont été obtenus au laboratoire de cocons récoltés en forêt au mois de mai (KASSIM, 1988).
C. melanoscela peut jouer un rôle important dans la transmission mécanique d'entomopathogènes (Virus, Bactéries) d'une chenille de L. dispar à l'autre. D'autre part la maladie, en ralentissant le développement des larves, permet une augmentation du nombre des individus susceptibles d'être parasités (REARDON et PODGWAITE, 1976; RAIMO et al., 1977; WESELOH et ANDREADIS, 1982; WESELOH et al., 1983; DUBOIS et LEWIS, 1983).
Le traitement des chenilles de L. dispar par le Diflubenzuron (cf. chap. VII) ne semble pas affecter notablement le développement ni la fécondité du parasite (GRANETT et WESELOH, 1975; GRANETT et al ., 1975).
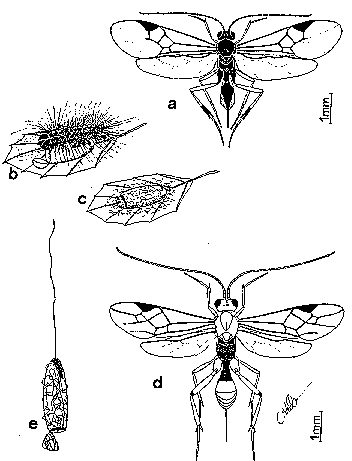
Figure 29. Hyménoptères Braconides
a: Cotesia melanoscela (imago); b: chenille de Lymantria
dispar parasitée; c: cocon de Glyptapanteles porthetriae;
d: Meteorus pulchricornis (imago); e: son cocon.
2.2. Glyptapanteles (Apanteles)
porthetriae et Dolichogenidea (Apanteles)
lacteicolor
Ces deux Braconides, signalés pour la première fois au Maroc sur L. dispar par FRAVAL et al. (1975) n'ont qu'un impact insignifiant sur les populations du ravageur en Mamora. Leurs cocons de nymphose, d'aspect laineux (ou "frisés") (fig. 29c), se distinguent par la couleur, celui de G. porthetriae (MUESEBECK) est blanc pur et ècelui de D. lacteicolor (VIERECK) jaune citron. Leur biologie est précisée par VILLEMANT (1989).
2.3. Meteorus pulchricornis (fig. 29e et 1f)
La larve âgée (stade III) de M. pulchricornis (WESMAEL)quitte son hôte, se laisse tomber de quelques cm de hauteur au bout d'un fil, qu'elle sécrète, et tisse aussitôt un cocon cireux brun en forme de fuseau. L'adulte (3-4 mm) de couleur orangée, émerge du cocon en découpant à son extrémité un petit opercule (DE LEPINEY, 1927).
L'espèce, fréquente en Mamora, était considérée par DE LEPINEY (1930) comme le principal ennemi de L. dispar après C. melanoscela, provoquant, entre 1924 et 1930, en moyenne 8 % de la mortalité des chenilles. En 1987 et 1988, ses destructions ont été beaucoup plus fortes, dépassant 25 % de l'effectif des chenilles en mai 1988 (KASSIM, 1988). Mais l'activité du Braconide est très fortement limitée par l'action des prédateurs (surtout la Fourmi Acrocoelia scutellaris (OLIVIER) et celles d'hyperparasites; en 1988 plus de 45 % des cocons de M. pulchricornisétaient parasités, principalement par l'Ichneumonide Gelis areator (KASSIM, loc. cit.).
Présent dans beaucoup de pays d'Europe où il parasite les chenilles de divers Lépidoptères (FERRIERE, 1927), M. pulchicornis est peu retrouvé sur L. dispar pour qui il demeure souvent un ennemi occasionnel (DREA, 1978; FUESTER et al., 1983).
La femelle de M. pulchricornis attaque les chenilles des stades II et III. Elle possède une grande capacitéde découverte de l'hôte, une forte agressivité et une bonne aptitude au vol, mais cependant une faible fécondité(50 oeufs environ). A 24°C, le développement de l'oeuf dure 3 j, chacun des 3 stades larvaires 9 à 10 j et la nymphose 8 j; les adultes peuvent survivre plus d'1 mois (DOANE et McMANUS, 1981).
Le parasitoïde ne présente normalement qu'une génération sur L. dispar mais une 2ème génération partielle semble possible en Europe certaines années. On ignore à quel stade hiverne le Braconide qui a besoin d'un hôte intermédiaire pour achever son cycle. L'absence d'hôte convenable a probablement empéché son acclimatation aux Etats-Unis (FUESTER et al., 1983).
2.4. Hyperparasites
De nombreux Hyménoptères attaquent les cocons des Braconides antagonistes de L. dispar (cf. tabl. IX). On connaît plus de 56 espèces de parasites de C. melanoscela à travers le Monde (GRIFFTHS, 1976). Ce sont surtout des Ichneumonides Gelinae et des Chalcidiens Pteromalidae et Eulophidae (SCHEDL, 1936; ROMANYK et RUPEREZ, 1960; DOANE et McMANUS, 1981). Ces Insectes, pour la plupart très polyphages, détruisent souvent entre 20 et 50 % et parfois jusqu'à 90 % de cocons du parasitoïde (SHAPIRO, 1956, DOANE et McMANUS, loc. cit.; QUEDNAU, 1983; WESELOH, 1978, 1983, 1986a).
Au Maroc, FERRIERE (1927) a déterminé 4 parasitoïdes communs à C. melanoscela et M. pulchricornis: les Gélinés Gelis (Hemiteles) areator (PANZER) et G. (Pezomachus) nigritus (FORSTER) et les Pteromalides, Dibrachys carvus (WALKER) (= boucheanus RATZEBURG) et Habrocytus (Hyjopteromalus) poecilopus (GRAWFORD). G. areator et D. cavus sont encore les hyperparasites les plus communs de L. dispar en Mamora. Ces 2 espèces, en juin 88, ont détruit plus de 45 % des cocons de M. pulchricornis et avec un petit Chalcididae, Brachymeria sp., 18 % environ des très nombreux cocons de C. melanoscela (KASSIM, 1988). Une 2ème génération d'hyperparasites est possible sur les cocons diaposants de ce dernier; des adultes de D. cavus ont ainsi été obtenus en juillet 1985 à Bou-Hani (VILLEMANT, non publié).
3. Les Tachinaires
Ces Tachinaires attaquent toutes les chenilles âgées de L. dispar; elles ne quittent parfois leur hôte qu'après sa chrysalidation. Près d'une dizaine de Tachinaires parasitent L. dispar au Maroc; seules 4 d'entre-elles ont été déterminées (VILLEMANT, 1989). Palexorista inconspicua (MEIGEN), la plus fréquente, est connue depuis DE LEPINEY (1930). Elle sera seule décrite ici.
Les taux de mortalité attribués aux Tachinaires varient beaucoup selon les pays et selon le niveau de la gradation (CAMPBELL, 1967a; ROMANYK, 1973; SISOSEVIC, 1979; RABASSE et BABAULT, 1975; REARDON, 1976; DREA, 1978; LUCIANO et PROTA, 1983; 1985; FUESTER et al., 1983; HAMRA KROUA, 1986). Leur action est fortement réduite lors des épidemies dues aux virus et aux bactéries entomophatogènes (BARBOSA et al., 1975; HERARD et al., 1979; LUCIANO et PROTA, 1982, 1985; FUESTER et al., 1983).
Ce sont en principe les espèces oligophages univoltines qui exercent la plus forte pression parasitaire sur les populations de L. dispar et dominent pendant les périodes de pullulation du ravageur (SHAPIRO, 1956; SISOJEVIC, 1979; LUCIANO et PROTA, loc. cit.; FUESTER et al., loc. cit.).
Les pupes de Tachinaires sont souvent attaquées par des hyperparasites notamment les Chalcidiens D. cavus et Monodontomerus aereus (WALKER); elles peuvent être aussi la proie de prédateurs comme le Carabide C. sycophanta (ROMANYK, 1973; CAMPBELL, 1975; RABASSE et BABAULT, 1975; LUCIANO et PROTA, 1982).
Palexorista (Sturmia) inconspicua (fig. 30)
Très largement répandue en Europe, en Afrique du Nord où elle parasite un très grand nombre d'espèces de Lépidoptères et d'Hyménoptères Tenthrèdinides, elle est généralement considérée comme un ennemi occasionnel de L. dispar (SCHEDL, 1936; SHAPIRO, 1956).
Au Maroc, la Tachinaire présenterait au moins 3 générations par an (DE LEPINEY, 1930) dont 2 printanières à developpement rapide direct et une 3ème diapausante. Seule la 1ère génération de printemps peut avoir lieu sur L. dispar en Mamora. Le parasite a probablement plusieurs autres hôtes dont le Lasiocampide Taragama repanda (HUBNER), espèce très polyphage qui ne s'attaque ni au Chêne-liège ni au Poirier de la Mamora (DE LEPINEY, loc. cit., DE LEPINEY et MIMEUR, 1932).
En Mamora, les adultes de la génération hivernante de P. inconspicua apparaissent en mai (DE LEPINEY, 1930), les mâles émergeant 2 jours avant les femelles. Le taux sexuel est voisin de 1. L'accouplement a lieu 24 h après l'émergence et peut durer plusieurs heures. Le développement embryonnaire s'effectue à l'intérieur des ovaires et une semaine après son accouplement la femelle dépose de 100 à 120 oeufs (macrotypes) prêts à éclore sur les pleures ou la face ventrale des chenilles de L. dispar. L'éclosion de l'oeuf et la pénétration du jeune asticot dans le corps de son hôte sont très rapides (1 h, au plus). Les cas de superparasitisme ne sont pas rares mais la plupart du temps, un seul individu poursuit son développement dans l'hôte. Chaque stade larvaire dure entre 2 et 3 j, la larve âgée quitte son hôte pour se nymphoser à 1 cm de profondeur dans le sol ou dans les amas de débris accumulés sous les écorces. Les adultes émergent 1 à 2 semaines plus tard et peuvent vivre plusieurs semaines, se nourrissant de miellat. Une femelle non fécondée peut survivre 2 mois (SCHEDL, 1936; DOANE et McMANUS, 1981).
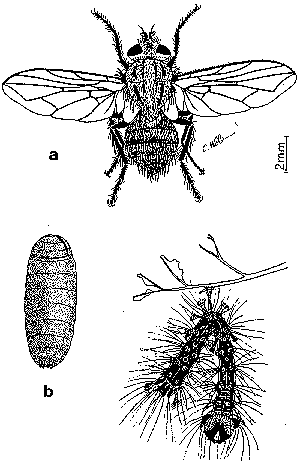
Figure 30. Palexorista inconspicua
a: adulte; b: pupe; c: chenille de Lymantria dispar parasitée.
Sur T. repanda, DE LEPINEY (1930) a obtenu une autre génération à la fin de l'été. Les pupes apparues en octobre ont donné des adultes 15 j plus tard.
L'aspect de la pupe permet une reconnaissance rapide de l'espèce: sa surface très rugueuse retient les particules de terre et lui donne souvent une coloration brun grisâtre; 2 stigmates très proéminents dépassent nettement de son extrémité postérieure et portent à leur surface 3 petits lobes caractéristiques.4.
4. Parasitoïdes et hyperparasitoïdes des
chrysalides
Au Maroc, toutes les espèces qui parasitent les chrysalides de L. dispar sont des Hyménoptères. On a recensé parmi eux au moins 5 espèces d'Ichneumonides: Coccygomimus (Pimpla) instigator (F.) et C. turionellae moraguesi (SCHMIEDEKNECHT), Vulgichneumon (= Melanichneumon) sp. et 2 espèces non déterminées et une espèce de Chalcididae: Brachymeria intermedia (NEES) (HERARD et FRAVAL, 1980; KASSIM, 1988). Une autre espèce de Chalcidien, Monodontomerus aereus (Torymidae) a été trouvée pour la première fois au Maroc à Bou-Hani en 1985 (VILLEMANT, non publié).
Mis à part B. intermedia, seul présenté ici, tous ces parasitoïdes sont peu fréquents et toujours très peu abondants dans les populations de chrysalides du Bombyx disparate quelque soit le niveau de leur gradation (HERARD et FRAVAL, loc. cit.; CHAKIR et FRAVAL, 1985; KASSIM, loc. cit., VILLEMANT, 1989).
Brachymeria intermedia (fig.31)
B. (Chalcis) intermedia est un gros Chalcididae (6 à 8 mm) aisement reconnaissable à sa couleur noire et jaune et à ses fémurs globuleux. Le thorax entièrement noir est ponctué dorsalement. Les fémurs noirs sont tachés de jaune à leur extrémité postérieure. Les tibias courbes qui se replient contre les fémurs sont noirs à leur face ventrale et jaunes dorsalement (DOWDEN, 1935).
B. intermedia, très polyphage, s'attaque surtout aux Lépidoptères (une vingtaine d'hôtes connus) parmi lesquels il semble souvent préférer L. dispar (DOWDEN, loc. cit.; SCHEDL, 1936; GRIFFITHS, 1976; MARCU et TUDOR, 1978; MINOT et LEONARD, 1976a). Le Chalcidien se développe parfois dans les pupes des Tachinaires ou les nymphes des Ichneumonides parasites du Bombyx disparate mais les cas d'hyperparasitisme demeurent peu fréquents (DOWDEN, loc. cit.; RABASSE et BABAULT, 1975; MARCU et TUDOR, loc. cit.). En outre, la piqûre des femelles de B. intermedia, même non suivie de ponte, peut causer une forte mortalité parmi les chrysalides blessés (MINOT et LEONARD, loc. cit.; BARBOSA et al., 1986a); elle pourrait aussi faciliter la pénétration de champignons entomopathogènes (ROMANYK, 1966; RABASSE et BABAULT, 1975).
B. intermedia parasite les chrysalides de L. dispar dans la plupart des pays d'Europe et d'Afrique du Nord; il se montre surtout actif durant les phases de pullulation du ravageur et concentre ses attaques dans les secteurs les plus défoliés ou à la périphérie des sites boisés. La mortalité provoquée par le parasitoïde concerne alors fréquemment plus de 50 % des effectifs du Bombyx disparate; à l'inverse le Chalcidien ne détruit guère plus de 5 à 10 % des chrysalides de son hôte lorsque celui-ci est peu abondant (FERRIERE, 1927; DOWDEN, 1935; SCHEDL, 1936; ROMANYK, 1973; RABASSE et BABAULT, 1975; CERVERA et HAM, 1976; CABRAL, 1977; LUCIANO et PROTA, 1982; HAMRA KROUA, 1986).
A Bou-Hani comme en Mamora, en 1987 et 1988, les chrysalides mortes de L. dispar étaient nombreuses (20 à 30 % des effectifs) et 1/4 d'entre elles environ contenaient une nymphe morte de ce parasitoïde (VILLEMANT, KASSIM, non publ.).
B. intermedia a été introduit en Amérique du Nord où il s'est bien acclimaté sans toutefois parvenir à limiter de façon satisfaisante les populations de L. dispar (DOANE et McMANUS, 1981; ROTHERAY et BARBOSA, 1984). Dans de rares cas, l'abondance de certains hôtes intermédiaires (Tortricidae) a permis une augmentation rapide des effectifs du parasitoïde qui a détruit alors un plus grand nombre de chrysalides du Bombyx disparate (MINOT et LEONARD, 1976a). Comme en Europe, le Chalcidien est plus actif dans les sites ouverts et ensoleillés; sa multiplicationest maximale au laboratoire sur les chrysalides de L. dispar des populations en phase de pullulation (MINOT et LEONARD, 1976b; BARBOSA et FRONGILLO, 1977; BARBOSA et al., 1978; GREENBLATT et BARBOSA, 1980).
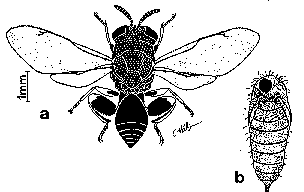
Figure 31. Brachymeria intermedia
a: imago; b: chrysalide de Lymantria dispar
parasitée.
Les grandes étapes du cycle biologique de B. intermedia ainsi que les caractères morphologiques de chaque écophase ont été décrits par DOWDEN (1935). Les études récentes consacrées à ce Chalcidien ont porté sur son comportement et ses capacités de reproduction et de recherche de l'hôte (LEONARD et al., 1975; GREENBLATT et BARBOSA, 1981; ROTHERAY et BARBOSA, 1984; ROTHERAY et al., 1984; KHOO et al., 1985; BARBOSA et al., 1986a).
B. intermedia présente 2 à 3 générations estivales mais une seule (la 1ère en général) a lieu normalement sur L. dispar. Les femelles de la dernière génération (et parfois celles de générations précédentes) hivernent dans la litière ou sous les écorces tandis que tous les mâles meurent à la fin de l'été. Au printemps, les femelles hivernantes fécondées attendent la chrysalidation des chenilles de L. dispar pour déposer leurs oeufs. Les femelles vierges ne peuvent donner que des mâles par parthénogénèse arrhénotoque et doivent attendre l'émergencedes mâles de la génération suivante pour être fécondées à leur tour.
L'oviposition débute 2 à 3 j après l'accouplement. Chaque femelle de B. intermedia recherche activement les chrysalides de L. dispar, une kairomone facilitant la découverte et la reconnaissance de cet hôte. La femelle du parasitoïde s'accroche alors à la chrysalide et, résistant à ses violents mouvements de défense, perfore sa capsule céphalique et y dépose un oeuf; elle ne la quitte qu'après avoir consommé quelques gouttes du liquide nymphal coulant de la blessure. Une femelle dépose environ 6 oeufs par jour, sa fécondité totale étant de 50 oeufs.
L'oeuf éclot au bout de 48 h et libère une jeune larve à la capsule céphalique bien individualisée qui s'alimente aussitôt. Le superparasitisme est fréquent mais l'une des larves néonates élimine ses congénères. Chacun des 5 stades larvaires dure 48 h. Installée depuis le 2ème stade au niveau des ébauches alaires de la chrysalide, la larve du parasitoïde termine son développement dans la capsule céphalique de son hôte, consommant rarement tout le liquide nymphal qui finit par se déssécher. La larve âgée bourrée de graisse atteint 10 mm, elle èse nymphose au niveau de la tête ou au centre de la chrysalide. Après 2 semaines, l'adulte émerge par un trou circulaire situé le plus souvent à l'avant du corps de l'hôte.
La durée totale du développement de B. intermedia est d'environ 27 j à 23°C, les femelles émergeant 2 j après les mâles. Les adultes sont de bons voiliers; ils se nourrissent de nectar et de miellat. Les chances de survie du parasitoïde sont plus grandes quand son hôte est plus petit.
5. Les prédateurs
Ce groupe d'ennemis naturels (cf. tabl. IX) n'a jamais eu de rôle décisif sur l'évolution des populations de L. dispar au Maroc; seuls les Oiseaux et les Insectes Carabidae et Formicidae peuvent être considérés comme de réels antagonistes de ce ravageur en Mamora. D'autres espèces ne sont que des prédateurs très occasionnels comme l'Araignée Epeira sp. qui capture parfois quelques jeunes chenilles de L. dispar dans sa toile. Le Ténébrionidé Akis tingitana, en s'attaquant aux chenilles et aux chrysalides mortes ou mourantes, se comporte plutôt en nécrophage qu'en véritable prédateur (HERARD et FRAVAL, 1980). Quant à la Tarente, Tarentola mauretanica (L.) (Gekkonidae), très abondante sur le Chênes-liège en Mamora, elle se nourrit d'au moins 10 espèces de chenilles (M. THEVENOT, com. pers.) mais son action sur L. dispar n'a pas été démontrée (KASSIM, 1988) pas plus que celle d'éventuels petits Mammifères. En Amérique du Nord, des Rongeurs et une Musaraigne sont d'importants antagonistes du Bombyx disparate; leur impact, très variable, peut devenir décisif là où les chenilles de L. dispar ont tendance à se nymphoser dans la litière (CAMPBELL, 1975; 1976; CAMPBELL et SLOAN, 1976; 1977; CAMPBELL et al., 1977).
5.1. Oiseaux
Les observations de DE LEPINEY (1930), CHAKIR (1981), KASSIM (1988) et surtout THEVENOT (non publié) ont permis d'établir une liste de 10 espèces d'oiseaux se nourrissant des chenilles du Bombyx disparate (cf. tabl. IX). Certains (non identifiés) peuvent aussi à l'occasion capturer au vol des papillons mâles du ravageur. La biologie des oiseaux d'Afrique du nord est décrite par ETCHECOPAR et HUE (1964).
La mortalité exercée par les oiseaux sur les populations de L. dispar n'a jamais été quantifiée au Maroc; dans d'autres pays ils sont considérés comme d'importants antagonistes des populations peu denses du Lymantriide, c'est le cas dans certaines régions des Etats-Unis (CAMPBELL et al., 1977; CAMPBELL et TORGERSEN, 1983) et au Japon (FURUTA, 1976). Ce dernier auteur constate que les Oiseaux ont un rôle de première importance lors de pullulationstrès localisées du Bombyx disparate; par leur comportement aggrégatif, ils peuvent contrecarrer efficacementla multiplication du ravageur.
5.2. Carabidae
Scarites occidentalis (BEDEL) et Calosoma sycophanta (L.) sont les deux seuls Coléoptères Carabidae dont on a observé le comportement prédateur vis-à-vis de L. dispar au Maroc; la mortalité qu'ils provoquentest généralement faible. S. occidendalis a parfois été trouvé en assez grand nombre en forêt de la Mamora tandis que C. sycophanta, très abondant dans le Moyen-Atlas, a été, en subéraie atlantique, surtout observé dans la région de Aïn-Felfel. Il a presque toujours été rare en Mamora où ses populations sont limitées notamment par l'action prédatrice du Moyen-duc (A. FRAVAL, comm. pers. in CHAKIR et FRAVAL, 1985).
Le Calosome sycophante (fig. 32) est un gros Carabe de 25 à 35 mm de long aux belles couleurs métalliques.Le corselet transverse est bleu, les élytres aux épaules marquées sont vertes à reflets cuivrées et leur surface est régulièrement striée. La larve aux sclérites noirâtres et aux pièces buccales bien développées mesure 6 mm à l'éclosion et atteint 4 cm à la fin de son développement. (CAMPBELL, 1975; WESELOH, 1986b).
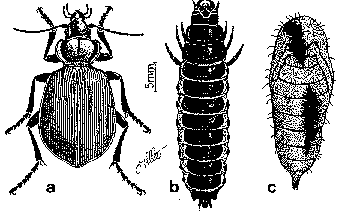
Figure 32. Calosoma sycophanta
a: imago; b: larve; c: chrysalide de Lymantria dispar dévorée.
La prédation exercée au Maroc par les imagos du Calosome sur les chenilles de L. dispar n'a jamais été évaluée, par contre les dégâts causés par les larves ont pu être mesurés par le dénombrement des chrysalides prédatées, aisement reconnaissables à leurs blessures aux bords déchiquetés. En 1979, dans quelques rares stationsdu "Transect", au nord-ouest de la forêt de Mamora (FRAVAL et al., 1980), le Calosome a tué exceptionnellement jusqu'à 31% des chrysalides de L. dispar (FRAVAL et MAZIH, 1980). En 1988 la proportion de chrysalides prédatées n'atteignait que 14% dans les station canton A de cette mêm forêt où le ravageur était le plus abondant (KASSIM, 1988). En 1985, à Bou-Hani, nous avons constaté que C. sycophanta avait tué près de 4 % des très nombreuseschrysalides d'une zone totalement défoliée par le Bombyx disparate.
C. sycophanta est considéré dans de nombreux pays comme l'un des principaux prédateurs de L. dispar; son activité est maximale durant les périodes de pullulation du défoliateur (ROMANYK, 1966; RABASSE et BABAULT, 1975; LUCIANO et PROTA, 1985; BASSET et al., 1986; HAMRA KROUA, 1986). L'action du Calosome a été spectaculaire en Corse entre 1955 et 1975: son intervention massive 3 ou 4 ans après le début des gradations mettait fin aux pullulations de L. dispar (CERVERA et HAM, 1976).
Très largement répandu en Europe et en Asie le Calosome sycophante a été introduit aux Etats-Unis et au Canada (SCHEDL, 1936; GRIFFITHS, 1976) où son impact est loin d'être négligeable; dans certains régions il tue jusqu'à 40 % en moyenne des chenilles et des chrysalides du Bombyx disparate, la mortalité qu'il provoque pouvant atteindre 75 % en phase de rétrogradation du ravageur (CAMPBELL, 1976; WESELOH, 1985c).
La biologie et le comportement de C. sycophanta ont été décrits par DUSSAUSSOY (1963), RIESGO (1964), WESELOH (1985b et c, 1986a, 1987b), FERRERO, 1985). Les oeufs sont déposés au printemps à quelques cm dans le sol, ils éclosent en quelques jours et les jeunes larves grimpent aussitôt sur les troncs à la recherche de leurs proies. Après 3 stades larvaires la larve s'enfonce dans le sol pour se nymphoser dans une coque terreuse. L'adulte émerge 3 à 5 semaines près la ponte mais peut aussi rester dans sa loge jusqu'à printemps suivant. Les Calosomes vivent 2 à 4 ans; ils sont actifs chaque année durant 3 à 4 semaines et passent les autres mois dans le sol, enfermés dans une logette de terre. Le 3ème année leur activité dure 2 mois durant lesquels a lieu la reproduction.Les femelles qui peuvent s'accoupler plusieurs fois déposent une centaine d'oeufs par an pendant 2 années consécutives.
L'activité prédatrice des Calosomes est considérable; ils s'attaquent à de nombreux Lépidoptères mais manifestent souvent une préférence pour le Bombyx disparate. Seuls Carabes capables de grimper avec agilité le long des troncs, ils saisissent leurs proies avec leurs mandibules puis se laissent tomber à terre pour mieux la maîtriser. Ils remontent ensuite rapidement sur l'arbre pour procéder à une nouvelle capture; parfois, il ne consomme sa proie que partiellement. Chaque couple consomme 80 à 120 chenilles de L. dispar en saison normale et entre 200 et 240 en période de reproduction. Les larves de stade III peuvent dévorer près de 40 chenilles et 13 chrysalides; leur activité est plus importante dans le bas des arbres où elles tuent jusqu'à 70 % des chrysalides contre 30 à 35 % dans la frondaison, se nourrissant aussi bien d'individus sains que parasités.
Les Calosomes sont des bons voiliers, leur dispersion comme leur capacité de reproduction augmentent avec la densité des populations de leurs proies; lorsque celles-ci sont trop peu abondantes certains adultes du Calosome restent dans le sol et survivent ainsi 7 à 10 ans, entre 2 périodes de pullulation de L. dispar.
5.3. Fourmis
Acrocoelia (Cremastogaster) scutellaris (OLIVIER) et Aphaenogaster senilis disjuncta (SANTSCHI) sont 2 Myrmicinae fréquentes sur les troncs de Chêne-liège en Mamora (BERNARD, 1943; 1969).
Les ouvrières de A. scutellaris sont petites (3 à 5 mm) elles ont un corps rouge et un abdomen noir qu'elles relèvent au dessus de leur corps en une position de défense caractéristique. Cette espèce est présente dans l'ensemble de la subéraie marocaine; elle creuse ses galeries dans le liège causant parfois d'importants dégâts. Ses colonies se répartissent irrégulièrement occupant dans certains secteurs de la Mamora de 40 à 100% des arbres. La biologie de cet Insecte et son impact sur la production de liège ont été étudiés par BELARBI (1979).
A. senilis, un peu plus grande qu'A. scutellaris, est de couleur uniformement noir opaque; elle est moins abondante en Mamora.
Ces 2 espèces, qui s'attaquent occasionnellement aux pontes de L. dispar, se nourrissent surtout des jeunes chenilles et les chrysalides nouvellement formées; elles s'intéressent aussi aux individus malades et dévorent activement les cocons de Braconides présents sur les troncs. Leur impact sur le Bombyx disparate demeure très faible (BELARBI, loc. cit.). D'autres espèces de fourmis prédatent aussi L. dispar en Amérique du Nord (CAMPBELL, 1975b).
[R] Vers le sommaire de l'ouvrage. Vers la page Lymantria dispar.